Porque acreditamos que os átomos existem, se não os enxergamos? O que são modelos atômicos? Como eles são propostos? Porque existem diferentes modelos atômicos? Através do estudo do comportamento dos átomos foi possível construir cada vez mais equipamentos tecnológicos mais rápidos e mais leves, como os celulares e notebooks. Mas, até hoje o homem não foi capaz de enxergar o átomo por dentro. Durante séculos e até mesmo nos dias atuais, tentar compreender o interior dos átomos é uma curiosidade dos homens, que desafia os antigos filósofos aos mais atuais cientistas.
Com base nessa argumentação, descreveremos à seguir uma breve explanação sobre esse assunto.
O átomo é a menor partícula capaz de identificar um elemento químico e participar de uma reação química.
Os átomos são compostos de, pelo menos, um próton e um elétron. Podendo apresentar nêutrons (na verdade, apenas o o átomo de Hidrogênio não possui nêutron, é apenas um elétron girando em torno de um próton).
- Elétrons – Os elétrons são partículas de massa muito pequena (cerca de 1840 vezes menor que a massa do próton. Ou aproximadamente 9,1.10-28g) dotados de carga elétrica negativa: -1,6.10-19C. Movem-se muito rapidamente ao redor do núcleo atômico, gerando campos eletromagnéticos.
- Prótons – Os prótons são partículas que, junto aos nêutrons, formam o núcleo atômico. Possuem carga positiva de mesmo valor absoluto que a carga dos elétrons; assim, um próton e um elétron tendem a se atrair eletricamente.
- Nêutrons – Os nêutrons, junto aos prótons, formam o núcleo atômico. E, como possuem massa bastante parecida, perfazem 99,9% de toda a massa do átomo. Possuem carga elétrica nula (resultante das sub-partículas que os compõem), e são dispostos estrategicamente no núcleo de modo a estabilizá-lo: uma vez que dois prótons repelem-se mutuamente, a adição de um nêutron (princípio da fissão nuclear) causa instabilidade elétrica e o átomo se rompe.
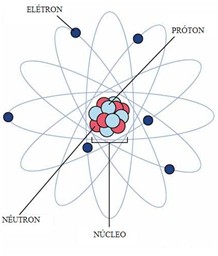
Modelos Atômicos
Modelo de Dalton (bola de bilhar) 1803
Para John Dalton, a teoria de Leucipo e Demócrito era bastante coerente. Segundo este modelo, os átomos eram as menores partículas possíveis, assumiam formas esféricas e possuíam massa semelhante caso fossem correspondentes ao mesmo elemento químico.
Modelo de Thomson (Pudim de Passas) 1897
Através da descoberta do elétron (partícula constituinte do átomo com carga elétrica negativa), o modelo de Dalton ficou defasado. Assim, com os estudos de Thomson, um novo modelo foi idealizado.
De acordo com este novo modelo, o átomo era uma esfera de carga elétrica positiva incrustada com elétrons, com carga negativa, tornando-se assim eletricamente neutro. Ficou conhecido como pudim de passas.
Modelo de Rutherford-Bohr (Sistema Planetário) 1908/1910
Rutherford ao bombardear partícula alfa sobre uma lâmina de ouro percebeu que a maioria atravessava a lâmina. Enquanto que uma menor parte sofria pequeno desvio, e uma parte ínfima sofria grande desvio contrário à trajetória.
A partir desse experimento, foi possível perceber que os átomos não eram maciços como se pensava, mas dotados de grande espaço vazio. Assim como, que eram constituídos por um núcleo carregado positivamente e uma núvem eletrônica carregada negativamente. Essa nuvem eletrônica era composta por elétrons que giravam em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol).
Texto extraído do site Info Escola.
Créditos: Júlio César Lima Lira
Para uma leitura mais abrangente e mais aprofundada sobre o assunto, clique no link abaixo.
O Átomo e a Tecnologia
